| |
patson
Oscilloscope
Un oscilloscope est un instrument de mesure destiné à visualiser un signal électrique, le plus souvent variable au cours du temps. Il est utilisé par de nombreux scientifiques afin de visualiser soit des tensions électriques, soit diverses autres grandeurs physiques préalablement transformées en tension au moyen d'un convertisseur adapté.
On distingue généralement les oscilloscopes analogiques qui utilisent directement un multiple de la tension d'entrée pour produire la déviation du spot et les oscilloscopes numériques qui transforment, préalablement à tout traitement, la tension d'entrée en nombre. L'affichage est reconstruit après coup. Il devient alors une fonction annexe de l'appareil qui peut même en être dépourvu, la visualisation du signal étant effectuée par un ordinateur extérieur relié à l'oscilloscope.
Les oscilloscopes analogiques

Accessoire de prise de vue Tektronix modèle C-5A pour film Polaroid à développement instantané.
Ce type d'appareil est en voie d'obsolescence car il ne permet généralement que l'observation de tensions périodiques. Il est de plus en plus remplacé par les oscilloscopes numériques.
Ne sont décrites dans ce paragraphe que des généralités concernant les calibres de tension et la base de temps d’un oscilloscope analogique.
Fonctionnement interne de l’oscilloscope
Le signal à mesurer est visualisé sur un tube cathodique généralement vert. La trace de l’oscilloscope est déterminée par deux composantes : une horizontale et une verticale.
Le mode XY permet :
- de visualiser des caractéristiques de dipôle, à la condition qu'une des tensions soit l'image du courant qui traverse le dipôle ;
- de visualiser un déphasage entre deux tensions sinusoïdales.
- de générer une courbe "couple en fonction de la vitesse de rotation", permettant de tracer la caractéristique d'un moteur électrique asynchrone et de définir le ou les quadrants utilisés.
La base de temps
Signaux visualisés par un oscilloscope multitrace.
La base de temps est caractérisée par une tension en dents de scie appliquée aux deux plaques verticales (voir schéma). En même temps, le canon à électrons projette un faisceau d'électrons entre les deux plaques (la densité du faisceau correspond à l'intensité lumineuse) :
- Le champ électrique, créé par la tension en dents de scie entre les plaques, fait dévier les électrons de leur trajectoire d’origine.
- L'abscisse de la nouvelle trajectoire dépend directement de la valeur de la tension en dents de scie.
- Afin que l’utilisateur puisse voir cette tension, les électrons percutent l’écran fluorescent de l’oscilloscope en produisant une tache lumineuse nommée spot.
- Sous l'action de la tension en dent de scie le spot se déplace à vitesse constante de gauche à droite puis revient brutalement à gauche, c'est le balayage.
- Pour que l'observateur puisse voir la forme caractéristique d'un courant alternatif il faut que les motifs dessinés par le spot soient exactement superposés d'un balayage sur l'autre, c'est le rôle du déclenchement qui démarre le balayage quand la tension verticale atteint une valeur définie par l'utilisateur.
Tension appliquée par l’utilisateur
- De la même manière que pour la base de temps, la visualisation de la tension appliquée à l’entrée de l’oscilloscope par l’utilisateur se fait à l’aide des plaques horizontales (voir schéma) qui font dévier la trajectoire des électrons verticalement.
- La position en ordonnée dépend directement de la tension appliquée par l’utilisateur. La base de temps fonctionnant en permanence, la tension d’entrée (amplifiée auparavant) évolue au cours du temps.
Utilisation des entrées différentielles
Lors de l'utilisation d'oscilloscopes alimentés par le réseau électrique que l'on cherchera à visualiser, différents problèmes peuvent apparaitre :
- Défaut d'isolement entre l'oscilloscope et son alimentation, pouvant provoquer des court-circuits lors des mesures.
- Défaut d'isolement entre plusieurs entrées de l'oscilloscope. Par exemple, si l'oscilloscope est utilisé pour la visualisation de tension sur un circuit RLC série et que l'on mesure la tension aux bornes de la résistance et la tension aux bornes du condensateur, les différentes masses de mesures seront portées au même potentiel, ce qui peut être dangereux.
Pour éviter ces défauts, on peut soit utiliser des oscilloscopes à entrées différentielles intégrées, soit utiliser une ou plusieurs sondes différentielles. Ces appareils auront pour but d'assurer l'isolation galvanique (avec des optocoupleurs par exemple) entre les différents potentiels de mesure sur le circuit et les potentiels de l'oscilloscope (entrée et masse).
Les oscilloscopes numériques
Contrairement aux modèles analogiques, le signal à visualiser est préalablement numérisé par un convertisseur analogique-numérique (interface A/D). La capacité de l'appareil à afficher un signal de fréquence élevée sans distorsion dépend de la qualité de cette interface.
Les principales caractéristiques à prendre en compte sont :
- La résolution du convertisseur analogique-numérique.
- La fréquence d'échantillonnage en Mé/s (mégaéchantillons par seconde) ou Gé/s (gigaéchantillons par seconde).
- La profondeur mémoire.
L'appareil est couplé à des mémoires permettant de stocker ces signaux et à un certain nombre d'organes d'analyse et de traitement qui permettent d'obtenir de nombreuses caractéristiques du signal observé :
L'affichage du résultat s'effectue de plus en plus souvent sur un écran à cristaux liquides, ce qui rend ces appareils faciles à déplacer et, beaucoup moins gourmands en énergie.
Les oscilloscopes numériques ont désormais complètement supplanté leurs prédécesseurs analogiques, grâce à leur plus grande portabilité, une plus grande facilité d'utilisation et, surtout, leur coût réduit.
Articles connexes
Liens externes
Sur les autres projets Wikimedia :
| [masquer]
Instruments de mesure |
| Voir aussi Palette Instruments de mesure météorologique |
| Acoustique |
Acoumètre · Audiomètre · Applaudimètre · Sonomètre |
| Angles et Position |
Axiomètre · Boussole · Cercle répétiteur · Compas · Demi-carré · GPS · Graphomètre · Goniomètre · Inclinomètre · Rapporteur · Octant, Quadrant et Sextant · Sitomètre · Théodolite · Tiltmètre |
| Composition chimique |
Alcoomètre · Butyromètre · Galactomètre · pH : pH-mètre · Spectrofluoromètre (ou fluorimètre) · Spectromètre de masse · Uromètre |
| Distances |
Altimètre · Bathymètre · Cale étalon · Capteur de déplacement · Cathétomètre · Chaine d'arpenteur · Comparateur · Curvimètre · Dendromètre · Dilatomètre · Fissuromètre · Iconomètre · Interféromètre · Jauge d'épaisseur · Jauge à flotteur · Jauge de déformation · Jauge de profondeur · Machine à mesurer tridimensionnelle · mètre ruban & mètre pliant · Micromètre · Odomètre, Taximètre · Pied à coulisse · Podomètre · Règle, Kutsch, Typomètre · Sphéromètre · Stadimètre · Tachéomètre · Télémètre, Célomètre · Toise · Vernier |
| Grandeurs cinématiques |
Accéléromètre · Anémomètre · Annubar · Cinémomètre · Compte-tours · Sonde Pitot · Tachymètre · Vélocimètre · Vibromètre laser |
| Grandeurs mécaniques |
Baromètre · Clé dynamométrique · Densimètre · Dynamomètre · Manomètre · Pénétromètre · Rhéomètre · Tensiomètre · Tribomètre · Vacuomètre · Viscoanalyseur · Viscosimètre |
| Grandeurs électriques |
Courant électrique : Galvanomètre, Ampèremètre · Charge électrique : Électromètre · Potentiel électrique : Voltmètre · Résistance : Ohmmètre, Mégohmmètre (mesure des résistances d'isolement), Telluromètre (mesure des résistances de terre), Conductimètre · Spectromètre (décomposition des composantes spectrales d'un signal électrique) · Capacimètre (mesure des capacités des condensateurs) · Coulombmètre · Diélectrimètre (mesure des constantes diélectriques) · Fréquencemètre (mesure de la fréquence d'un signal électrique) · Multimètre (multiples mesures de valeurs électriques : tension, intensité, résistance, etc.) · Oscilloscope (mesure de tension, fréquence et période) |
| Électromagnétisme et Optique |
Actinomètre · Bolomètre · Colorimètre (spectre lumineux) · Champ magnétique : Fluxmètre, Inductancemètre (mesure de l'inductance d'un circuit inductif), Magnétomètre, Teslamètre · Diffractomètre · Luxmètre · Photomètre · Polarimètre · Radiomètre · Strabomètre |
| Puissance, énergie |
Wattmètre |
| Quantité de matière |
Analyseur thermogravimétrique · Balance · Compteur Geiger · Détecteur de particules (Chambre à brouillard, Chambre à bulle, Chambre à étincelles, Chambre à fils, Chambre d'ionisation) · Dosimètre · Humidité : Hygromètre et Thermo-hygromètre, Thermobalance · Oxymètre · Pèse-personne · Peson · Poids public · Radiamètre |
| Superficies |
Planimètre |
| Température |
Calorimètre · Thermistance · Thermocouple · Thermomètre · Thermoscope |
| Temps |
Astrolabe · Cadran solaire · Chronomètre · Clepsydre · Datation radioactive · Horloge · Horloge atomique · Minuteur · Montre · Pendule · Sablier |
| Volumes et débits |
Aréomètre · Burette · Courantomètre · Débitmètre · Eudiomètre · Éprouvette graduée · Fiole jaugée · Fluviomètre · Maréomètre · Micropipette · Pipettes graduée, jaugée et compte-gouttes · Pycnomètre · Spiromètre (médecine) · Verre doseur (cuisine) |
| Voir aussi Palette Capteur |
|
Les oscilloscopes servent aussi bien aux professionnels qu' aux chercheurs pour des analyses de laboratoire ou de recherche scientifique.  Vous pourrez trouver des oscilloscopes avec des plages de 60, 100, 150 et encore jusqu'à 250 MHz, des oscilloscopes analogiques et numériques, des oscilloscopes en temps réel et/ou avec mémoire pour l'enregistrement des valeurs. En plus, les oscilloscopes sont équipés de deux à quatre canaux, et en outre ont un écran monochromatique ou bien en couleurs. Pour certains modèles il existe un logiciel optionnel pour imprimer les données de l'écran ou pour transférer les données de mesure vers un PC. Tous les oscilloscopes que nous vous proposons possèdent un tube d'images de longue durée et respectent les normes de sécurité IEC1010 1 / CAT II. Les quotes-parts d'exploration élevées sont garanties par tous les canaux simultanément. Les oscilloscopes sont livrés prêts à être utilisés (avec des têtes inclues, l'assurance de rechange, un câble de réseau et aussi le mode d'emploi). Bien sur, pour bien utiliser les oscilloscopes et après analyser les valeurs obtenues, il faut connaître les concepts essentiels de ce domaine de mesure. En cas de doute en ce qui concerne les oscilloscopes ou leur utilisation dans la pratique professionnelle, n'hésitez pas à nous contacter au +33 (0) 972 3537 17. Nos techniciens et ingénieurs vous conseilleront sur ce type d'oscilloscopes et bien entendu sur les autres produits du domaine de la technologie de laboratoires, des systèmes de régulation et contrôle, des mesureurs ou des balances de PCE Instruments. Vous pourrez trouver des oscilloscopes avec des plages de 60, 100, 150 et encore jusqu'à 250 MHz, des oscilloscopes analogiques et numériques, des oscilloscopes en temps réel et/ou avec mémoire pour l'enregistrement des valeurs. En plus, les oscilloscopes sont équipés de deux à quatre canaux, et en outre ont un écran monochromatique ou bien en couleurs. Pour certains modèles il existe un logiciel optionnel pour imprimer les données de l'écran ou pour transférer les données de mesure vers un PC. Tous les oscilloscopes que nous vous proposons possèdent un tube d'images de longue durée et respectent les normes de sécurité IEC1010 1 / CAT II. Les quotes-parts d'exploration élevées sont garanties par tous les canaux simultanément. Les oscilloscopes sont livrés prêts à être utilisés (avec des têtes inclues, l'assurance de rechange, un câble de réseau et aussi le mode d'emploi). Bien sur, pour bien utiliser les oscilloscopes et après analyser les valeurs obtenues, il faut connaître les concepts essentiels de ce domaine de mesure. En cas de doute en ce qui concerne les oscilloscopes ou leur utilisation dans la pratique professionnelle, n'hésitez pas à nous contacter au +33 (0) 972 3537 17. Nos techniciens et ingénieurs vous conseilleront sur ce type d'oscilloscopes et bien entendu sur les autres produits du domaine de la technologie de laboratoires, des systèmes de régulation et contrôle, des mesureurs ou des balances de PCE Instruments.
Actuellement nous disposons d’une gamme d'oscilloscopes des fabricants suivants:
Vous trouverez les caractéristiques des oscilloscopes dans notre magasin en ligne ou dans nos liens suivants:
|
|
Oscilloscopes de table / Oscilloscopes pour laboratoires
|
|
|
- Oscilloscopes PCE-SDS 10xx
(oscilloscopes avec large de bande 25 / 50 MHz, fréquence d’échantillonnage jusqu’à 1 GS/s, écran TFT)
|
  |
|
- Oscilloscopes PCE-DSO 5000
(oscilloscopes avec large de bande de jusqu’à 200 MHz, fréquence d’échantillonnage 1 GS/s, écran TFT de 7")
|
  |
|
- Oscilloscopes PKT-1255
(oscilloscopes avec sortie VGA, grande capacité de mémoire interne, large de bande de 100 MHz)
|
  |
|
- Oscilloscopes PKT-1240
(oscilloscopes avec grande capacité de mémoire interne, large de bande de 60 MHz, 2 canaux CH)
|
  |
|
- Oscilloscopes PKT-1200
(oscilloscopes à écran couleur 8", largeur de bande 25 MHz, interface USB, fonction Auto-Set)
|
  |
|
- Oscilloscopes PKT-1190
(oscilloscopes enregistreurs numériques avec analyseur logique, largeur de bande 100 MHz, 500 MS/s)
|
  |
|
- Oscilloscopes PKT-1245
(oscilloscopes avec écran en couleur TFT de 800 x 600 pixels, large de bande de 100 MHz)
|
  |
|
- Oscilloscopes PKT-1230
(oscilloscopes enregistreurs avec analyseur logique intégré 16 canaux, largeur de bande 200 MHz, 1 GS/s)
|
  |
|
- Oscilloscopes PKT-1260
(oscilloscopes avec connexion USB pour le transfert de données, large de bande 200 MHz)
|
  |
|
- Oscilloscopes PKT-1265
(oscilloscopes avec écran couleur TFT et 800 x 600 pixels, 30 MHz de bande passante)
|
  |
|
Oscilloscopes portables
|
|
|
- Oscilloscopes PCE-UT 81B
(oscilloscopes portables, 40 MS/s, 8 MHz largeur de bande, interface USB)
|
  |
|
- Oscilloscopes PKT-1220
(oscilloscopes 1 canal avec multimètre, largeur de bande 20 MHz, interface USB)
|
  |
|
- Oscilloscopes PKT-1205
(oscilloscopes avec multimètre intégré, largeur de bande 20 MHz, 2 canaux, interface USB)
|
  |
|
- Oscilloscopes ScopeMeter 120 Série
(oscilloscopes compact de deux canaux de 40 ou 20 MHz, fonction de multimètre, mesure de puissance)
|
  |
|
- Oscilloscopes PKT-1195
(oscilloscopes avec multimètre intégré, 2 canaux, largeur de bande 100 MHz, interface USB)
|
  |
|
- Oscilloscopes PCE-DSO 8060
(oscilloscopes portables avec fonction de multimètre, largueur de bande 60 MHz, 2 canaux)
|
  |
|
- Oscilloscopes ScopeMeter 190 Série
(oscilloscopes pour la détection d’erreurs dans l’industrie, 60 MHz jusqu’à 500 MHz, 2 ou 4 canaux)
|
  |
|
- Oscilloscopes DSO Scopix OX7042
(oscilloscopes DSO avec fonction de multimètre, largueur de bande 40 MHz, 2 canaux)
|
  |
|
- Oscilloscopes DSO Scopix OX7062
(oscilloscopes DSO avec fonction de multimètre, largueur de bande 60 MHz, 2 canaux)
|
  |
|
- Oscilloscopes DSO Scopix OX7102
(oscilloscopes DSO avec fonction de multimètre, largueur de bande 100 MHz, 2 canaux)
|
  |
|
- Oscilloscopes DSO Scopix OX7202
(oscilloscopes DSO avec fonction de multimètre, largueur de bande 200 MHz, 2 canaux)
|
  |
|
- Oscilloscopes DSO Scopix OX7104
(oscilloscopes DSO avec fonction de multimètre, largueur de bande 100 MHz, 4 canaux)
|
  |
|
- Oscilloscopes DSO Scopix OX7204
(oscilloscopes DSO avec fonction de multimètre, largueur de bande 200 MHz, 4 canaux)
|
  |
|
Oscilloscopes pour PC
|
|
|
- Oscilloscopes PCSU 1000
(oscilloscopes pour PC, jusqu'à 50 MS/s, interface USB, analyseur de spectre)
|
  |
|
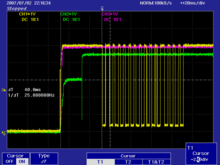
Quelques oscilloscopes, comme les oscilloscopes PCE-OC 1, ont une mémoire interne et peuvent envoyer et évaluer les résultats de la mensuration à un ordinateur (moyennant un RS-232 et logiciel).
|
Vérification de la tension du réseau
avec la série d'oscilloscopes
PCE-OC 1
|

Test de la plaque interne d'un appareil électronique
avec les oscilloscopes W-20 TRMS
|

Test des masses électriques d'un véhicule
avec les oscilloscopes PCE-DM 22
|
|
|
Information générale sur les oscilloscopes: Les oscilloscopes sont des mesureurs électroniques de visualisation graphique qui indiquent des signaux électriques variables dans le temps. L'axe vertical, appelé Y, représente le voltage, alors que l'axe horizontal, appelé X, représente le temps. Les images qui apparaissent à l'écran s'appellent des oscillogrammes. Il existe des oscilloscopes analogiques et d'autres oscilloscopes numériques. Cependant, notre société ne vous propose que des modèles numériques. Les oscilloscopes numériques utilisent au préalable un convertisseur analogique-numérique (A/D) pour stocker numériquement le signal d'entrée, et reconstruisant a posteriori cette information sur l'écran. Les oscilloscopes numériques s'utilisent pour visualiser et étudier des cycles périodiques non répétitifs. Les oscilloscopes numériques ont, en plus des sections expliquées ci-dessus, un système supplémentaire de traitement de données qui permet de stocker et de visualiser le signal. Pour des signaux à variation lente, les oscilloscopes numériques peuvent parfaitement réunir plus de points dont il a besoin afin de pouvoir reconstituer ensuite le signal sur l'écran. Cependant, pour des signaux rapides, les oscilloscopes ne peuvent pas prendre suffisamment d'échantillons et doivent utiliser une de ces deux techniques. La méthode standard d'échantillonnage dans les oscilloscopes numériques est un échantillonnage en temps réel: l'oscilloscope réunit les points suffisants pour reconstruire le signal. Pour des signaux non répétitifs ou pour la partie transitoire d'un signal, il s'agit de la seule méthode d'échantillonnage valable. Tous nos oscilloscopes sont calibrages selon la réglementation ISO. Ce qui vous permet de faire confiance totale à nos appareils.
|
|
Paramètres importants des oscilloscopes
Vous trouverez à la suite une liste des caractéristiques techniques les plus importantes de nos oscilloscopes:
- Bande passante: elle nous indique la plage de fréquence dans laquelle les oscilloscopes peuvent mesurer avec précision. La bande passante se calcule de 0Hz (continue) jusqu'à la fréquence à laquelle un signal du type sinusoïdal est visualisé à 70,7% de la valeur appliquée à l'entrée.
- Temps de remontée: Il s'agit d'un autre paramètre qui nous donnera, avec la bande passante, la fréquence maximum d'utilisation de l'oscilloscope. C'est un paramètre important pour mesurer avec fiabilité les pulsions et les flancs (n´oublier pas que ces types de signaux ont des transitions très rapides entre les niveaux de tension ). Les oscilloscopes ne peuvent pas visualiser les pulsions avec des temps de remontée plus rapides que les leurs.
- Sensibilité verticale: elle indique la facilité des oscilloscopes à amplifier des signaux faibles. Elle est normalement donnée en mV par division verticale, étant généralement de l'ordre de 5mV/div (pouvant aller jusqu'à 2 mV/div).
- Vitesse: pour les oscilloscopes analogiques cette spécification nous indique la vitesse maximum du balayage horizontal, ce qui nous permet d'observer des évènements plus rapidement. Ils sont de l'ordre de nano secondes par division horizontale.
- Vitesse d'échantillonnage: dans les oscilloscopes numériques, le nombre d'échantillons par seconde que le système d'acquisition de données (en particulier le convertisseur A/D) est capable de prendre en compte est indiqué . Quand les oscilloscopes sont de bonne qualité, ils peuvent atteindre des vitesses d'échantillonnage de Mégaéchantillons / sec. Une grande vitesse d'échantillonnage est importante pour pouvoir visualiser de courtes périodes de temps. A l'autre bout de l'échelle, les basses vitesses d'échantillonnage sont aussi nécessaires pour pouvoir observer des signaux à variation lente. Normalement la vitesse d'échantillonnage change en utilisant la commande TimeBase pour maintenir une constante dans le nombre de points qui s´emmagasineront pour représenter la forme de l'onde.
- Résolution verticale: elle mesure en bits et il s'agit d'un paramètre qui nous donne la résolution du convertisseur A/D de l'oscilloscope numérique. Elle nous indique avec quelle précision les signaux d'entrée se convertissent en valeurs numériques enregistrées dans la mémoire. Des techniques de calcul peuvent augmenter la résolution effective des oscilloscopes.
- Longueur du registre: elle nous indique combien de points sont mémorisés dans un registre pour la reconstruction de la forme d'une onde. Certains oscilloscopes nous permettent de varier ce paramètre dans une certaine limite. La longueur maximum du registre dépend des dimensions de la mémoire des oscilloscopes. Une grande longueur de registre permet d'effectuer des zooms sur les détails dans la forme d'onde de façon rapide (les données ont déjà été stockées), cependant cet avantage a comme inconvénient le fait d'avoir besoin de plus de temps pour échantillonner le signal total.
- Exactitude dans le profit: elle nous indique la précision avec laquelle le système vertical des oscilloscopes amplifie ou atténue le signal. Il est normalement donné en pourcentage maximum d'erreur.
- Exactitude de la base des temps: elle nous indique la précision dans la base des temps du système horizontal des oscilloscopes pour visualiser le temps. Normalement le pourcentage d'erreur maximum est aussi donné.
|
|

Vérification de la réponse échelonnée de la sortie
du processeur avec un de nos oscilloscopes.
|
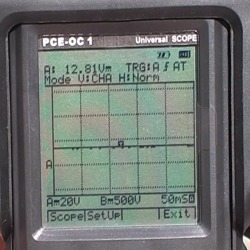
Ecran des oscilloscopes de la série PCE où l'on peut
voir le résultat d'une mesure effectuée.
|

Positionnement des pinces pour la mesure dans
les oscilloscopes du canal A.
|
|
|
Certificat de calibrage ISO
Vous pourrez obtenir un certificat de calibrage ISO des oscilloscopes. Une certification et un calibrage de laboratoire pour les oscilloscopes un certificat de révision avec l'adresse de votre société est délivré pour que vous puissiez par exemple, fournir les oscilloscopes dans vos consortiums dans les propres entreprises d'instruments de contrôle ISO, et il sera certifié que ces oscilloscopes peuvent à nouveau être ajustés selon les standards nationaux. Vous pourrez trouver ci-après de plus amples informations relatives au calibrage:
- Calibrage: Révision de la précision des magnitudes mesurées des oscilloscopes sans intervention dans le système de mesure. Ou bien: détermination de la déviation systématique de l'écran des mesureurs par rapport à la valeur réelle de la magnitude mesurée.
- Certificat de calibrage: il prouve les caractéristiques techniques de mesure des oscilloscopes ainsi que la possibilité de récupérer le patron de mesure national.
- Intervalle de calibrage: Pour pouvoir réaliser des mesures correctes, les oscilloscopes employés doivent être vérifiés ou calibrés périodiquement. Cette période de temps correspond à l'intervalle de calibrage. Il n'existe pas de normes qui indique qu'il faille de nouveau calibrer les oscilloscopes. Pour pouvoir déterminer l'intervalle, il est nécessaire de tenir compte des points suivants:
- Magnitude mesurée et bande de tolérance permise dans les oscilloscopes
- Utilisation des mesureurs et des instruments de contrôle
- Fréquence d'usage des oscilloscopes
- Conditions de l'environnement des oscilloscopes
- Stabilité du calibrage précédent des oscilloscopes
- Précision de mesure nécessaire des oscilloscopes
- Dispositions relatives au système de contrôle de qualité des sociétés des oscilloscopes
Cela signifie que l'utilisateur doit finalement lui-même fixer et contrôler la période entre deux calibrages. Nous recommandons d'établissement d'un intervalle de calibrage pour les oscilloscopes de 1 à 3 ans. Nous proposons à nos clients notre aide professionnelle afin de résoudre les doutes pouvant subvenir à propos du désir de vouloir augmenter la fixation de cet intervalle.
|
|
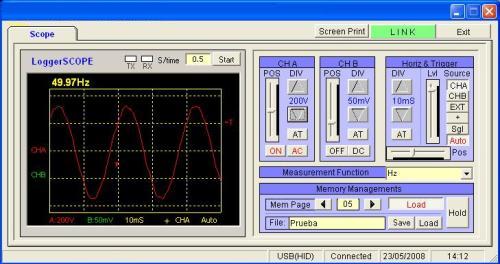
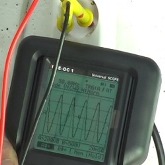
Sur la photo vous pouvez observer que la mesure de la fréquence du réseau
électrique est de 50 Hz avec le logiciel des oscilloscopes PCE-OC 1
|
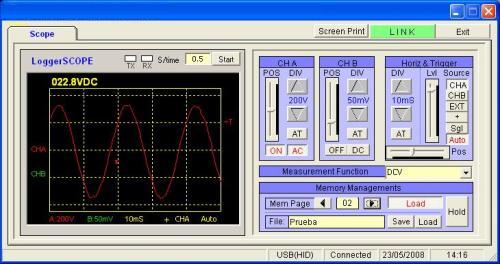
Sur cette autre photo vous pouvez voir que la mesure de la tension du réseau
électrique est de 230V en AC avec le logiciel des oscilloscopes PCE-OC 1
|
|
Sur les photos ci-dessus, vous pouvez observer que la mesure de la fréquence du réseau électrique est de 50 Hz (photo de gauche) et la mesure de la tension du réseau électrique est de 230V en AC (photo de droite) avec le logiciel des oscilloscopes PCE-OC 1
|
|
|
Loi d'Ohm
George Simon Ohm fut un physicien allemand célèbre pour ses recherches sur les courants électriques. Sa formulation de la relation entre l'intensité du courant, la différence de potentiel et la résistance contribue à la loi d'Ohm, avec laquelle il établit dans sa loi que la quantité de courant qui circule Oscilloscopes avec écran couleur TFT et 800 x 600 pixels, 30 MHz de bande passanteOscilloscopes avec écran couleur TFT et 800 x 600 pixels, 30 MHz de bande passante dans un circuit fermé par des résistances pures est directement proportionnelle à la force électromotrice appliquée à un circuit, et inversement proportionnelle à la résistance totale du circuit. Cette loi est normalement exprimée avec la formule I= V/R, où I représente l'intensité du courant mesuré en ampères, V la force électromotrice en volts et R la résistance en ohms.
L'unité de résistance électrique a été appelée ohm en son honneur et fut définie en 1893.
La loi d'Ohm n'est pas une loi naturelle fondamentale mais une relation empirique valable uniquement pour certains matériaux. Les matériaux qui ont une constante de résistance sur une vaste plage de voltages et les matériaux qui ne suivent pas cette loi sont appelés non linéaires et ont une relation de courant-voltage non linéaire. Les matériaux qui suivent cette loi s'appellent conducteurs ohmiques ou conducteurs linéaires et ont une relation de courant-voltage sur une vaste plage de voltages appliqués.
La loi d'Ohm est la loi de base pour le flux du courant. Le courant circule dans un circuit électrique en suivant plusieurs lois.
Qu'est-ce qu'un circuit série?
Un circuit représente des dispositifs ou les éléments du circuit disposés de telle manière que la totalité du courant passe à travers chaque élément sans division ni dérivation dans des circuits parallèles.
Cette loi s'applique aussi bien pour les circuits électriques de courant continu et de courant alternatif, que pour analyser des circuits plus complexes. Il faut utiliser d'autres principes supplémentaires à cette loi.
Actuellement pour résoudre théoriquement les circuits électroniques on prend comme référence que le courant doit toujours circuler du sens positif au négatif. Récemment il a été démontré que le sens réel que ces électrons suivent est tout à fait le contraire: du négatif au positif mais pour la résolution théorique de ces circuits ce qui est toujours pris en compte est du sens positif au sens négatif, c'est-à-dire suivant la loi d'Ohm.
|
|
Principe de fonctionnement des oscilloscopes
Quand nous avons un circuit et nous désirons observer la réponse du signal qui en résulte, il faudra connecter une sonde à l'élément que nous voulons vérifier pour voir le résultat de ce circuit ou son composant. Le signal ira de la sonde à la section verticale, que nous pourrons amplifier ou atténuer grâce aux commandes digitales dont dispose les oscilloscopes. Une fois le signal amplifié, grâce au module antérieur, il s'enverra à la section horizontale pour que, grâce à ce pas et au pas précédent et grâce aussi aux différents procédés tels que les convertisseurs A/D, l'écran montre le signal recherché. Si la tension de ce signal est positive en référence avec le point de référence ou GND, il sera indiqué dans la partie supérieure de l'écran et par contre si elle est négative, il sera indiqué dans la partie inférieure.
Comme indiqué ci-dessus, le signal passe de la sonde jusqu'à la section verticale, et de celle-ci il passe à la section horizontale, non sans passer avant par la section de déclenchement qui est chargée de bouger le signal de la partie gauche à la partie droite d'un temps déterminé (grâce à cela il est aussi possible d'obtenir une stabilisation du signal). Ce parcours est obtenu grâce à la base du temps (TIME-BASE).
Les réglages de base devant s'effectuer pour une utilisation correcte des oscilloscopes sont:
- Commande Ampli (atténuation ou amplification) - Cette commande règle l'amplitude du signal ou des signaux dépendants des
oscilloscopes dont on dispose. Il faut que le signal occupe tout l'écran sans dépasser les limites de celle-ci.
- Commande Timebase (échelle de temps) - Cette commande règle le temps par quadrillage représentée par une division de l'écran.
- Commande Trigger Level et Trigger Selector (niveau de déclenchement / type de déclenchement) - Avec ces commandes il est
possible d'obtenir la meilleure stabilisation possible des signaux qui se répètent plusieurs fois.
- De plus il est aussi très important de régler les paramètres de mise au point, d'intensité et de positionnement des signaux
dans les axes X et Y.
Les oscilloscopes en plus de ces réglages possède une mémoire pour effectuer des mesures prolongées et pouvoir transférer ces données à un PC.
|
|
Si vous désirez voir ou imprimer la section de ces oscilloscopes dans notre catalogue,
cliquez sur le symbole PDF
Annonce relative à téléchargement winrar 64 bits
-
www.webcrawler.com/
Search multiple engines for winrar download free 64 bit
Résultats de recherche
-
www.commentcamarche.net/.../telecharger-34096559-winrar-64-bits
Il y a 3 jours - WinRAR est un logiciel spécialement conçu pour la compression et la décompression de fichier ou dossier. Il est possible de sauvegarder les ...
-
www.commentcamarche.net/.../telecharger-34096559-winrar-64-bit
3 déc. 2013 - WinRAR est un logiciel spécialement conçu pour la compression et la décompression de fichier ou dossier. Il est possible de sauvegarder les ...
-
Télécharger Winrar 5.01 Windows Vista 64 bits, 7 (64 bits), 8 (64 bits), XP : La dernière mouture du compresseur - décompresseur de fichiers multi-format !
-
www.01net.com/telecharger/windows/Utilitaire/...et.../101558.html
Note : 3 - 1 vote
WinRAR est disponible en versions 32 bits et 64 bits pour vous aider à tirer le meilleur parti de votre système. Les performances de compression et de ...
-
winrar-64bit.softonic.fr/
Note : 3 - 8 votes - 40,39 $US - Windows - Utilitaires/Outils
WinRAR Télécharger gratuitement - WinRAR WinRAR 5.01: WinRAR 64-bit, un clône de la version 32-bit ?. WinRAR 64-bit est un logiciel de compression et de ...
-
Télécharger winrar 64 bits gratuit gratuit - TUGZip 3.5: Utilitaire gratuit pour tous vos fichiers archives, et bien plus de logiciels.
-
Téléchargement gratuit winrar 64 bit: téléchargement gratuit - WinRAR 5.01: L'un des meilleurs utilitaires de compression, et bien plus de logiciels.
-
Téléchargement gratuit winrar 64 bits francais - WinRAR 5.01: L'un des meilleurs utilitaires de compression, et bien plus de logiciels.
-
www.winrar64bit.org/francais/
L'application 64-bit WinRAR a été développé pour être un outil puissant de compression pour vous aider à organiser votre archives compressées de vos ...
-
Note : 4,5 - Gratuit - Windows - Utilitaires/Outils
WinRAR est un utilitaire de compression et de décompression de données capable de créer des archives avec l'extension RAR et ZIP et d'extraire des archives ...

|
Ces cours ont été créés avec autant de soin que possible, mais une coquille n'est pas exclue : toute critique de ces cours sera la bienvenue. Contact : Christophe HAOUY exemple : cours sur les machines thermiques Bibliographie : Introduction à la thermodynamique, de Claire Lhuillier et de Jean Rous, collection 1er cycle universitaire, éditions DUNOD, 1994. Cet ouvrage évite le formalisme mathématique (trop souvent présent en thermodynamique) et donne des exemples concrets d'illustrations du cours. Il s'agit de spécialistes en Thermodynamique (laboratoire de Physique théorique de Jussieu). Les machines transformatrices d'énergie, tome 1, par G. Lemasson, collection cours de Mécanique R. Basquin, éditions DELAGRAVE, 1963. Beaucoup de diagrammes accompagnent ce cours. L'ouvrage est vieux mais très abordable pour les BTS. Pour ma part j'ai consulté beaucoup d'ouvrages de classes préparatoires aux grandes écoles. Entres autres : Toute la thermodynamique, la mécanique des fluides et les ondes mécaniques, cours et exercices corrigés, classes préparatoires MPSI-PCSI, MP-PC-PSI, par L. Bocquet, J.P. Faroux et J. Renault.. Editions Dunod 2002. Thermodynamique, 2ème année PT – PT*. Gérard DAREAU, Georges ROUSSELET. Collection taupe-niveau. Editions Ellipses. 1998. Ce livre est d'un abord théorique élevé. Les rédacteurs se sont spécialisés dans la thermodynamique technique. Thermodynamique, problèmes résolus, 3ème édition, par Hubert Lumbroso, Mc Graw-Hill, 1984. Physique statistique. Cours de physique de Berkeley, volume 5. Armand Colin, 1994. Cours de Physique de Feynman, mécanique 2. Dunod, 1979. Atlas de la Physique, par Hans Breuer, collection Encyclopédie d'aujourd'hui. Livre de Poche, 1997. Je ne connais cependant pas la formation scientifique du (ou des) rédacteur(s). Certaines explications me paraissent erronées (le phénomène de cavitation dans les robinets domestiques par exemple). Nouvelle encyclopédie pratique de mécanique, tome 1, par Henri DESARCE, librairie Aristide Quillet, 1949. Cet ouvrage (évidemment épuisé) est une bible d'informations…sa vieillesse garantit l'utilisation de schémas ou de gravures qui représentent les machines thermiques à une époque où la photo n'était pas d'usage courant dans les livres, ce qui nécessite forcément une "épuration" du dessin qui présente l'essentiel et non le superflu. En outre les systèmes mécaniques sont clairement exposés. index1.gif (1121 octets) page d'accueil (académie de Nancy-Metz) retour.gif (1119 octets) retour BTS
1
UNIVERSITE IBN ZOHR
Ecole Nationale des Sciences Appliquées
d’Agadir
Filière Classe préparatoire
Première Année
COURS D’ATOMISTIQUE
Cours préparé par :
Dr. R. SALGHI,
Professeur Habilité à l’Ecole Nation
ale des Sciences Appliquées d’Agadir
Pr. L. BAZZI, Professeur à la Faculté des Sciences d’Agadir
Pr. A. BELHACHEMI, Professeur à la Faculté des Sciences d’Agadir
2
Chapitre I
STRUCTURE DE L'ATOME
CONSTITUANTS DE LA MATIERE
INTRODUCTION
La matière est formée à partir de grains élémentaires: les
atomes
. 112 atomes ou éléments
ont été découverts et chacun d'eux es
t désigné par son nom et son symbole.
Exemple
: Carbone : C ; Azote : N.
Les atomes diffèrent par leurs
structures et leurs masses, et
sont eux même fragmentés
en petites particules :
les électrons, les protons et les neutrons.
En fait, l'atome n'existe pas souvent à l'état
libre, il s'associe avec d'autres pour former
des molécules. On a des molécules
monoatomiques
: gaz rares ( He, Ne, Ar,...),
diatomiques
(H
2
, O
2
, NaCl,...) et des molécules
polyatomiques
(H
2
O, H
2
SO
4
,...).
I - ELECTRON
L'atome est un ensemble électriquement neutre
comportant une partie centrale, le noyau
( protons + neutrons ), où est
centrée pratiquement toute sa
masse, et autour duquel se
trouvent des électrons.
1 - Mise en évidence : Expérience de J.J. Thomson
Sous l'effet d'une tension électrique très élev
ée ( 40 000 volts) appl
iquée entre les deux
parties internes d'un tube à décharge, un
faisceau est émis de la cathode, appelé
rayons
cathodiques
et recueilli par l'anode.
Cathode tube en verre gaz Anode
- +
vide
rayons cathodiques
2- Propriétés des rayons cathodiques :
- Se propagent de façon
rectiligne
et
perpendiculaire
à la cathode.
- Ils sont constitués de particules qui transportent de
l'énergie
.
- Ils sont déviés par un champs électrique ve
rs le pôle positif, ce qui indique que les
particules constituant ces rayons sont chargées
négativement
.
En 1891, Stoney a donné le nom
d'électron
pour les particules constituant les rayons
cathodiques.
Les expériences de Thomson et Millikan,
nous ont permis de déterminer la charge
e
et la
masse
m
e
de l'électron :
e
= 1,602 . 10
-19
Coulomb ou C
m
e
=
9,109 . 10
-31
kg.
3
II - NOYAU
1- Mise en évidence : Expérience de Rutherford
L'expérience consiste à bombarder une très
mince feuille de métal (Or) par le
rayonnement constitué de noyaux d'Helium (He
2+
).
Ecran fluorescent
Feuille d'or
Source (He
2+
)
INTERPRETATION
La matière de la feuille d'or est constituée
essentiellement du vide. Sa masse se trouve
donc concentrée en certains points. Les particule
s passent dans leur grande majorité, entre ces
points de matière condensée que sont les
noyaux atomiques
.
La quasi-totalité des noyaux traversent la f
euille d'or sans être déviés. D'autres la
traversent en étant simple
ment déviés (1/100). En fin, très
peu de noyaux sont repoussés par la
feuille (1/20000).
2-
Constitution du noyau atomique
Le noyau est formé de particules élémentaire
s stables appelées nucléons, qui peuvent
se présenter sous deux formes à l'état libre, le
neutron
et le
proton
.
- Les protons sont chargés positivement :
q
p
= +e = 1,602 . 10
-19
C
- La masse du proton : m
p
= 1,673 . 10
-27
kg
≈
1836 m
e
- Les neutrons sont de charge nulle, leur masse est :
m
n
= 1,675 . 10
-27
kg.
Conclusion
:
Toute la masse de l'atome est concentrée dans le noyau.
III- IDENTIFICATION DES ELEMENTS
1- Représentation
A chaque élément chimique, on a associé
un symbole. Il s'écrit toujours avec une
majuscule, éventuellement suivie d'une minuscule :
A
Z
X
Z est appelé
numéro atomique ou nombre de charge,
il désigne le nombre de protons
( c'est aussi le nombre d'électrons pour un atome neutre).
Pour un élément quelconque,
la charge du noyau ( protons
) est +Ze. De même la
charge des électrons sera -Ze.
A est appelé
nombre de masse
, il désigne le nombre de nucléons (protons + neutons).
Si N représente le nombre de
neutrons, on aura la relation :
A = Z + N
4
2- Isotopes
Ce sont des atomes de même
numéro atomique Z et de nombre de masse A
différent. Un élément peut avoir un ou plusieurs isotopes.
Il n'est pas possible de les séparer par des
réactions chimiques, par contre cela peut
être réalisé en utilisant des techniques physi
ques notamment la spectroscopie de masse.
3- Masse atomique
La masse atomique est égale à la
somme des masses des constituants de l'atome :
m
at
= Zm
e
+ Zm
p
+ Nm
n
( en kg )
L'utilisation de cette unité n'est pas
commode, des unités chimiques plus faciles à
manipuler ont donc été choisies ; le te
rme de référence étant le carbone 12.
Par définition, l'unité de masse
atomique qu'on note u.m.a est le
12
1
ème de la
masse d'un atome de carbone 12 (
12
C).
u.m.a =
12
1
m
c
4- Mole et masse molaire
A notre échelle, on rais
onne sur une certaine qua
ntité de matière appelée
mole
:
La mole est la quantité de matière qui conti
ent autant d'atomes qu
'il y a dans 12g de
carbone 12. Le nombre est appelé
nombre d'Avogadro
N
:
N
= 6,0221. 10
23
Un tel nombre s'appelle donc une mole (
N
molécules) ou atome -gramme (
N
atomes).
Par définition
:
Une mole d'atomes de ca
rbone 12 pèse 12g. La masse d'
un atome vaut 12 u.m.a,
donc :
12 g =
N
. 12 u.m.a
ou encore
1 u.m.a = 1/
N
= 1,66 . 10
-24
g = 1,66 . 10
-27
kg.
Masse molaire
:
La masse d'une mole d'atomes d'un élémen
t est appelée la masse molaire de l'atome.
5- Masse atomique relative
Dans le cas général, un élément possède un ou plusieurs isotopes ; donc la masse
atomique sera la somme des proportions relatives à chaque isotope.
m =
Σ
(x
i
. m
i
) u.m.a
de même la masse molaire sera :
M =
Σ
(x
i
. M
i
) (g/mole)
5
CHAPITRE II
MODELES CLASSIQUES DE L'ATOME
I - MODELE DE RUTHERFORD
Ce modèle est basé sur l'existence du noy
au dans lequel est prat
iquement concentrée
toute la masse de l'atome et aut
our duquel gravitent des électrons.
La stabilité mécanique résulte de la
compensation des forces d'attractions
F
r
a
par les
forces centrifuges
F
r
c
dues à la rotation des électrons autour du noyau.
L'avantage de ce modèle c'est qu'il ne fait
appel qu'aux lois de la mécanique classique.
Par contre, il présente des inconvénients :
•
La théorie électromagnétique exige que l'électron rayonne des ondes
électromagnétiques, donc il va perdre de l'énergie
et finirait par tomber sur le noyau.
•
L'énergie lumineuse émise varie de façon continue.
Ces deux conclusions sont
en contradiction avec l'expérience.
II - MODELE DE BOHR
1- Description ( cas de l'atome d'hydrogène )
Pour lever les contradictions préc
édantes, Bohr propose quatre hypothèses :
•
Dans l'atome, le noyau est immobile
alors que l'électron de masse m se déplace
autour du noyau selon une orbite circulaire de rayon r.
•
L'électron ne peut se trouver que sur des
orbites privilégiées sans émettre de
l'énergie ; on les appelle
"orbites stationnaires".
•
Lorsqu'un électron passe d'un
niveau à un autre il émet ou abs
orbe de l'énergie :
∆
E = h.
ν
•
Le moment cinétique de l'électron ne
peut prendre que des
valeurs entières
(quantification du moment cinétique) :
mvr = n.h/2
π
h : constante de Planck et n : entier naturel.
2 - Aspect quantitatif de l'atome de Bohr
Le système est stable par les deux forces
F
r
a
et
F
r
c
:
•
Force d'attraction :
⏐
F
r
a
⏐
= e
2
/ 4
πε
0
r
2
•
Force centrifuge :
⏐
F
r
c
⏐
= mv
2
/ r
Le système est en équilibre si :
⏐
F
r
a
⏐
=
⏐
F
r
c
⏐
càd : mv
2
= e
2
/ 4
πε
0
r (1)
Energie totale du système :
E
T
= Ec + Ep Ec : énergie cinétique
Ep : énergie potentielle , elle est due à l'attraction du noyau
Donc Ep = F
a
dr = - e
2
/ 4
πε
0
r
D'autre part :
Ec = mv
2
/2
Donc : E
T
= - e
2
/ 8
πε
0
r (2)
6
Rayon de l'orbite :
On sait que : mvr = n.h/2
π
Donc mv
2
= n
2
h
2
/ 4
π
2
mr
2
(3)
(1) et (3) donnent : r =
ε
0
h
2
n
2
/
π
me
2
(4)
C'est le rayon de l'orbite où circule l'électron ; il est quantifié.
Si on remplace (4) dans (2), on obtient :
E
T
= -me
4
/ 8
ε
0
2
h
2
n
2
(5)
L'énergie totale d'un électron
est donc discrète ou quantifiée.
•
Pour n=1 (état fondamental : l'électron occupe l'orbite de rayon r
1
et d'énergie E
1
)
r
1
= 5,29.10
-11
m = 0,529 Å (1Å = 10
-10
m)
E
1
= -21,78.10
-19
j = -13,6 eV
(1eV = 1,6.10
-19
j)
•
Pour n =2 ( Pr
emier état excité )
r
2
= 4r
1
= 2,116 Å et E
2
= E
1
/4 = -3,4 eV
•
Pour n = 3 ( Deux
ième état excité )
r
3
= 9r
1
= 4,761 Å et E
2
= -1,51 eV
3 - Absorption et émission d'énergie
Un électron ne peut absorber ou libérer
de l'énergie càd rayonn
er qu'en passant d'un
niveau (orbite) à un autre.
La quantité d'énergie absorbée ou émise
est égale à la différence d'énergie entre les
deux niveaux (relation de Planck) :
∆
E =
⏐
E
f
- E
i
⏐
= h
ν
E
f
: état final
E
i
: état initial
h : constante de Planck
ν
: fréquence de radiation
Absorption
: Lorsqu'un électron passe d'un niveau n (orbite de rayon r
n
) à un niveau p
(p>n) supérieur (orbite de rayon r
p
), il absorbe une radiation de fréquence
ν
n-p
.
Emission
:
Lorsqu'un électron passe d'un
niveau p à un niveau n (p
> n), il émet une
radiation de fréquence
ν
p-n
.
III - RAYONNEMENT ELECTROMAGNETIQUE
Les rayons lumineux sont caractérisés
par la propagation d'une
onde électromagnétique
à la vitesse de la lumière (c = 3.10
8
m/s ). Cette onde est caract
érisée par sa longueur d'onde
λ
ou par son nombre d'onde
σ
:
λ
= 1/
σ
= c/
ν
ν
: la fréquence
Le spectre de l'ensemble des radiations peut
se présenter de la façon suivante :
R
γ
RX UV
Visible IR
Ondes radio
10 91
400 700 7400
λ
(nm)
7
IV - SPECTRE D'EMISSION DE L'ATOME D'HYDROGENE
Le spectre de raie de l'atome d'hydrogène
présente quatre raies principales dans le
domaine visible.
410 434
486 656
400 500 600
700
λ
(nm)
Quantification de l'énergie
:
L'énergie émise ou absorbée
par un électron est :
∆
E =
⏐
E
p
- E
n
⏐
= h
ν
p>n
∆
E = (1/n
2
- 1/p
2
) me
4
/ 8
ε
0
2
h
2
Or h
ν
= h.c/
λ
Càd 1/
λ
=
σ
= (1/n
2
- 1/p
2
) me
4
/ 8
ε
0
2
h
3
c
1/
λ
= R
H
(1/n
2
- 1/p
2
)
avec R
H
= me
4
/ 8
ε
0
2
h
3
c , appelé constante de Rydberg
Cette relation permet de calculer les différ
entes longueurs d'onde. En général, on trouve
plusieurs séries de spectre selon l'état où se trouve l'électron :
* Série de Lymann : n = 1
et p>1 (p = 2,3...,
∞
)
* Série de Balmer : n = 2 et p>2 (p = 3,4...,
∞
)
* Série de Paschen : n = 3 et p>3 (p = 4,5...,
∞
)
* Série de Brachett : n = 4 et p>4 (p = 5,6...,
∞
)
* Série de Pfund : n = 5 et p>5 (p = 6,7...,
∞
)
V - GENERALISATION AUX IONS HYDROGENOIDES
Ce sont des ions qui ne possèdent qu'un seul électron.
Exemple
:
He (Z=2) -------> He
+
(1e
-
et 2p)
Li (Z=3) -------> Li
2+
(1e
-
et 3p)
He
+
et Li
2+
sont des ions hydrogènoïdes. Leurs énergie totale s'écrit :
E
T
= Z
2
/ n
2
. (-me
4
/ 8
ε
0
2
h
2
)
E
T
= E
1
. Z
2
/ n
2
Avec E
1
= -13,6 eV , l'énergie de l'atome
d'hydrogène à l'état fondamental.
Le rayon d'une orbite de rang n d'un ion hydrogènoïde est :
r = n
2
/Z . (
ε
0
h
2
/
π
me
2
) ou encore r = r
1
. n
2
/Z
avec r
1
= 0,529 Å , étant le rayon de l'atom
e d'hydrogène à l'état fondamental.
1/
λ
=
σ
= (1/n
2
- 1/p
2
) Z
2
.me
4
/ 8
ε
0
2
h
3
c
1/
λ
= Z
2
.R
H
(1/n
2
- 1/p
2
)
VI - ENERGIE D'IONISATION
C'est l'énergie nécessaire pour amener l'électr
on de son état fondamental
vers l'infinie.
H ----h
ν
L
---> H
+
+ 1e
-
ionisation de l'atome d'hydrogène
∆
E = h
ν
L
= E
∞
- E
1
= 13,6 eV avec
ν
L
: fréquence limite et E
∞
= 0
8
CHAPITRE III
MODELE QUANTIQUE DE L'ATOME
I- NOTION DE LA MECANIQU
E QUANTIQUE (ONDULATOIRE )
1) Dualité onde - corpuscule : Postulat de De Broglie
A toute par
ticule (corpuscule) de masse m et de
vitesse v est associée une onde de
longueur d'onde
λ
. On applique ainsi à la matière (exemple : un électron) le caractère combiné
d'onde
et de
particule
.
La relation de De Broglie s'écrit :
λ
= h/mv
λ
: longueur d'onde
h : constante de Planck
mv : quantité de mouvement
2) Principe d'incertitude d'Heisenberg
Il est impossible de définir avec précision à la fo
is la position et la vitesse d'une particule.
Cela se traduit par la relation :
∆
x .
∆
p
x
≥
h/2
π
∆
x : incertitude sur la position
∆
p
x
= m
∆
v : incertitude sur la quantité de mouvement
3) Notion de la probabilité de présence
En mécanique classique (conception
de Bohr), l'étude du mouv
ement d'un électron
consiste à rechercher sa trajectoire avec pr
écision, par contre en
mécanique quantique
on parle de la
probabilité
de trouver l'électron en un certain point de l'espace.
Cette délocalisation dans l'espace es
t donnée par une fonction des coordonnées
de l'électron appelée
fonction d'onde
Ψ
.
La probabilité de présence est :
dP =
⏐Ψ
(x,y,z,t)
⏐
2
dV
La fonction d'onde
Ψ
doit satisfaire une certaine condition de normalisation :
P =
∫
espace
⏐Ψ⏐
2
dV = 1
On dit que la fonction d'onde est
normée
.
II - EQUATION DE SCHRÖDINGER
POUR L'ATOME D'HYDROGENE
On appelle orbitales atomiques, les fonc
tions d'ondes des électrons atomiques.
En 1926, Schrödinger a montré
que la fonction d'onde et l'éner
gie E sont solution d'une
équation aux dérivées partielles du second ordre.
L'équation de Schrödinger s'écrit :
[(-h
2
/8
π
2
m).
∆
+ V]
Ψ
= E
Ψ
m : masse de l'e
-
V : Opérateur énergie potentiel
E : énergie totale de l'électron, appelée valeur propre
Ψ
: fonction d'onde appelée fonction propre
9
Cette équation peut se mett
re sous la forme :
H
Ψ
= E
Ψ
C'est le principe fondamental
de la mécanique quantique.
H = (-h
2
/8
π
2
m).
∆
+ V
; est appelé opérateur Hamiltonien d'hydrogène
∆
=
∂
2
/
∂
x
2
+
∂
2
/
∂
y
2
+
∂
2
/
∂
z
2
; est le Laplacien
La résolution de cette équation condui
t aux différentes valeurs de E et
Ψ
:
E
n
= -me
4
/ 8
ε
0
2
h
2
n
2
C'est la même expression que celle trouvée par Bohr.
Avec la mécanique quantique on peut aussi
expliquer la quantific
ation de l'énergie.
Pour la fonction d'onde
Ψ
(orbitale atomique), elle fait intervenir trois nombres appelés
"
nombres quantiques
" qui caractérisent l'état
d'un électron. Ces trois nombr
es sont : n ; l et m :
∗
n : nombre quantique principal (n = 1,2,3,...
∞
) qui définit la couche quantique (énergie
de l'électron). On appelle couche l'ensemble des
orbitales qui possèdent la même valeur
de n.
∗
l est le nombre
quantique secondaire ou
azimutal, il peut prendr
e toutes les valeurs
comprises entre 0 et n-1 :
0
≤
l
≤
n-1
l définit la notion de sous-couche et détermi
ne la géométrie des orbitales atomiques.
∗
m est le nombre quantique m
agnétique, il définit la case qu
antique. m peut prendre toutes
les valeurs comprises entre
-l et +l :
-l
≤
m
≤
+l
∗
Il y a 2l+1 valeurs de m (2l+1 orbitales).
Chaque orbitale atomique est donc caractér
isée par une combinaison des trois nombres
quantiques n, l et m.
Dans la notation spectroscopique, à chaque
valeur de l, on lui
fait correspondre une
fonction d'onde que l'on désigne par une lettre :
* Si l = 0 , on dit qu'on a l'orbitale s
* Si l = 1
→
orbitale p
* Si l = 2
→
orbitale d
* Si l = 3
→
orbitale f
∗
Introduction du nombre quantique de spin
Pour décrire totalement l'électron d'un atom
e, il faut lui attribuer un quatrième nombre
quantique (noté s ou m
s
) lié à la rotation autour de lui-même.
Ce nombre ne peut prendre que deux valeurs :
S = 1/2 (
↑
) ou S = -1/2 (
↓
)
D'une façon générale, pour une couche n
donnée, on aura n sous-couches , n
2
orbitales et 2 n
2
électrons au maximum.
10
Représentation des orbitales
.
Chaque orbitale représente à
la fois la fonction d'onde
Ψ
et la distribution électronique
qui en découle (probabilité de présence).
1- Orbitale s :
Les orbitales s sont caract
érisées par l = 0 et m = 0
Toutes les orbitales s (ns) ; sont de symétri
e sphérique car la probabilité de présence de
l'électron varient de la même façon dans
toutes les directions autour du noyau.
2- Orbitales p :
Pour l = 1
⇒
m = -1 , 0 ou 1
⇒
3 orbitales p
On parle des orbitales p
x
, p
y
et p
z
ayant la même forme, mais chacune est allongée sur
une des trois axes perpendiculaires.
Une orbitale p possède un "pla
n nodal", dans lequel la
probabilité de trouver l'électron est
nulle. Ce plan passe par le noyau.
3- Orbitales d
:
Si l = 2
⇒
m = -2 ; -1 ; 0 ; 1 ; 2
⇒
5 orbitales d
4- Orbitales f
:
Si l = 3
⇒
m = -3 ; -2 ;
-1 ; 0 ; 1 ; 2 ; 3
⇒
7 orbitales f
IV - STRUCTURE ELECTRONIQUE
DES ATOMES POLY
ELECTRONIQUE
(CONFIGURATION ELECTRONIQUE )
La configuration électronique d'un atome est
la répartition de Z électrons de l'atome dans
un état fondamental sur les orbitales atomiques.
Ce remplissage des orbitales atomiques s'e
ffectue à l'aide des quatre règles générales.
a) Principe d'exclusion de PAULI
Dans un atome, deux électrons ne peuvent
pas avoir leurs quatre nombres quantiques
identiques :
Si deux électrons d'un atome occupent la même orbi
tale (même valeurs de n, l,m), ils diffèrent
forcement par le nombr
e quantique de spin ( l'un de spin +1/2 et l'autre de spin -1/2).
Remarque :
Une orbitale est définie par les trois nombres
n, l et m. Il est commode de représenter les
orbitales à l'aide de cases quantiques :
ns ns
np
nd
nf
Pour une couche n, le
nombre de cases est n
2
et le nombre d'électrons est 2n
2
. Une case
quantique ne peut contenir au maximum que 2 électrons de spins opposés.
a) Principe de stabilité
11
Les électrons occupent les niveaux d'énergie les pl
us bas dans la limite des places disponibles.
b) Règle de HUND
A l'état fondamental, quand
les électrons se placent dans une sous
-couche multiple (p, d, f), ils
occupent le maximum d'orbitales de même énergie
avec des électrons célibataires qui ont des
spins parallèles (même valeur de s).
c) Règle de KLECHKOVSKI
+
L'ordre des énergies croissantes est l'ordre des
valeurs croissantes da la somme ( n +l ) .
+
Si deux sous-couches correspondent
à la même valeur de ( n + l
) , la sous-couche, avec la
plus petite valeur de n, a l'énergie la plus basse.
+
Les orbitales d'une même sous-couche ont la même énergie.
Exceptions :
- Groupe du Chrome (Z = 24)
- Groupe du Cuivre (Z = 29)
Ces exceptions correspondent au demi-rempli
ssage et au remplissage complet de la
couche 3d. Elles s’expliquent par le faible
écart énergétique entre les orbitales 4s et 3d.
12
Chapitre IV
CLASSIFICATION PERIODIQUE ET PROPRIETES DES ELEMENTS
I) Description du tableau périodique de Mendelieff
Le tableau périodique est une conséquence
des configurations électroniques. La
classification périodique est basée sur la form
ation de groupes constitués
par les éléments (de
numéro atomique Z ) possédant des propriétés analogues.
∗
Le tableau périodique est consti
tué de 4 blocs : s, p, d et f.
∗
Les éléments d'une même ligne horizontale
du tableau périodique constituent une
période. Ils sont au nombre de 7.
∗
Les éléments d'une même colonne ayant la
même configuration électronique de la
couche externe constituent une famille ou groupe.
Le tableau périodique est c
onstitué de 18 colonnes r
éparties en 9 groupes. Les 7
premiers comportent chacun deux sous-gr
oupes A et B selon l'état des électrons
externes.
Sous-groupe A
: contient les éléments dont la couche externe est ns
np.
Sous-groupe B
: contient les atomes qui possèdent un état d.
Les indices I, II, III,... indiquent le nombre
d'électrons sur la couche externe, appelés
électrons de valence.
Les principales familles du tableau périodique sont :
Famille des alcalins : Groupe I
A
Les éléments dont la configurati
on électronique externe est du type
ns
1
.
Famille des alcalino-terreux : Groupe II
A
Leurs configurations électroni
ques externes sont de type
ns
2
.
Famille des halogènes : Groupe VII
A
Leurs configurations électroni
ques externes sont de type
ns
2
np
5
.
Famille des gaz rares
Tous ces éléments ont une configurat
ion électronique externe de la forme
ns
2
np
6
.
Famille des éléments de transition
Ce sont des éléments qui possèdent les orbitales
d incomplètement remplies
.
Eléments des triades
Ces éléments constituent le groupe VIII.
On distingue trois types de triades :
- Triade du Fer
(Fe, Co, Ni)
- Triade du palladium (Ru, Rh, Pd)
- Triade du platine (Os, Ir, Pt)
Eléments des terres rares
Ces éléments possèdent les orbitales f en
cours de remplissage. On distingue les
éléments qui correspondent au remplissage de l'orbi
tale 4f : on les app
elle les lanthanides.
Ceux qui correspondent au remplissage de l'orbitale 5f sont appelés les actinides.
13
II - Périodicité des propriétés
II-1- Rayon atomique r
a
On peut définir le rayon atomique comme étant
la moitié de la distance entre les centres
des deux atomes liés par une liaison simple.
•
Sur une période : si Z augmente alors r
a
diminue
•
Sur une colonne : si Z augmente alors r
a
augmente
II-2- Rayon ionique : r
i
D'une manière générale :
* Les cations sont plus petits
que leurs atomes parents : r
i
(cation) < r
a
* Les anions sont plus gros
que leurs atomes
parents : r
i
(anion) > r
a
* Pour les ions ayant la même
configuration électronique (S
2-
, Cl
-
, K
+
, Ca
2+
, Ti
4+
,...) :
si Z augmente ; r
i
diminue
* A charges égales, le rayon ionique varie dans le même sens que le rayon atomique :
si Z augmente alors r
i
diminue
II-3- Energie d'ionisation (EI
)
C'est l'énergie qu'il faut fournir pour arra
cher un électron à un atome (ou à un ion) dans
l'état fondamental et
à l'état gazeux.
•
Sur une même période : si
Z augmente alors E.I augmente.
•
Sur un même groupe : si Z augmente alors E.I diminue.
II-4- Affinité électronique (A.E)
C'est le phénomène inverse de l'ionisation.
L'affinité électronique d'un atome X est l'éne
rgie dégagée lorsque
cet atome capte un
électron.
II-5- Electronégativité (E.N)
C'est le pouvoir d'attirer un électron par un
élément. Un élément qui perd facilement un
ou plusieurs électrons est dit électropositif.
L'électronégativité
χ
d'un élément X peut être défin
it selon plusieurs échelles :
a- Echelle de Mulliken:
E.N(X) =
χ
(X) = [ E.I (X) + A.E (X) ] / 2
b- Echelle de Pauling :
E.N(X) - E.N(Y) = 0208
XY
∆
Avec
∆
xy
=
E
XY
-
2
2
Y
X
E
E
XY
E
: énergie de liaison de la molécule XY
2
X
E
et
2
Y
E
: énergies de liaison des molécules X
2
et Y
2
.
Pauling a fixé arbitrairement l'électronégativit
é du Fluor (élèment le plus électronégatif) :
E.N(F) =4
14
Evolution de l'électronégativité
dans la classification périodique :
•
Sur une même période : si
Z augmente alors E.N augmente
•
Sur un même groupe : si Z augmente alors E.N diminue
II-6- Valence
C'est la capacité de chaque atome à former une
liaison. Sa valeur
est égale au nombre
d'électrons non appariés (célibataires).
Exemple :
1) Hydrogène : 1s
1
; v= 1
2) Oxygène : 2s
2
2p
4
; v= 2
3) Potassium : 4s
1
, v = 1
II-7 Propriétés magnétiques
- Diamagnétisme :
Les atomes (ou molécules) ne poss
édant pas d'électrons célibataires
sont dit diamagnétiques.
-
Paramagnétisme
: Les atomes (ou molécules) pos
sédant des électrons célibataires
sont dit paramagnétiques.
15
Chapitre v
La liaison chimique
I- Définitions
a- Molécule
L’assemblage de deux ou plusieurs
atomes est appelé molécule :
A + B
-----> A – B
La liaison entre A et B ne pourra se former que si
l’énergie du système A – B est plus faible que
l’énergie des deux atomes séparés.
b- liaison covalente
C’est une liaison qui s’obtient par mise en
commun des électrons de
valence de deux
atomes en contact.
Les deux électrons qui forment
la liaison se trouvent à mi-dis
tance de chaque noyau atomique.
A. + B. ------> A -- :---B
c- Liaison ionique
Lorsque la différence d’électr
onégativité entre les atomes A et
B est très importante, les
électrons se trouvent attirés par l’atome le plus
électronégatif et la liaison est dite du type
ionique.
d- Moment dipolaire
Définition
Dans les molécules dissymétriques de ty
pe AB, les barycentres des charges
positives P et des charges négatives N
ne coïncident pas. Ces molécules sont
assimilables à un dipôle
caractérisé par un moment dipolaire μ, orienté
conventionnellement du moins vers le plus : μ = q. d
d : distance séparant les noyaux.
q = Z
A
.e + Z
B
.e
Z
A
et Z
B
sont les numéros atomi
ques des atomes A et B
Unité des moments dipolaires : le
debye définit par 1D = 0,33. 10
-29
C.m
Exemples
® ®
Cl
______
H F
______
Cl
μ = 1,08 D μ = 0,88 D
II- Représentation de Lewis
Lorsqu’un atome s‘associe pour
donner une molécule, il a tendance à saturer sa couche
externe et à prendre la configur
ation électronique du gaz rare le plus proche (règle de l’octet)
1-Cas des molécules diatomiques
Exemples :
F
2
; O
2
; N
2
; CN
-
; CO ...
16
2-
Cas des molécules polyatomiques
Exemples :
CH
4
, NH
4
+
, PCl
5
...
Le diagramme de lewis permet d’expliquer la fo
rmation d’une simple, double ou triple liaison
mais il ne peut pas, nous renseigner sur le type
de liaison ni sur la géométrie de la molécule.
III- Théorie des orbitales moléculaires
: Combinaison linéaire des orbitales
atomiques (LCAO)
Dans la théorie quantique, chaque électron
de l’atome est décrit par une orbitale
atomique
ψ
. Dans la molécule, chaque électron se
ra décrit par une fonction d’onde
Φ
appelée
orbitale moléculaire.
Les axes de symétrie des orbitales atomiques doi
vent être soit colinéaires soit parallèles.
Il y a deux types de recouvrement :
- Un recouvrement frontal (ou encore axia
le), lorsque les axes de symétries sont
colinéaires: la liaison est dite du type
σ
.
- Un recouvrement latéral lorsque les axes
de symétrie sont parallèles : La liaison est
dite du type
π
.
Il existe deux types d'or
bitales moléculaires :
- Orbitale moléculaire liante
responsable de la liaison ayant
une énergie plus faible que
celle des orbitales atomiques.
- Orbitale moléculaire anti-liante qui a t
endance à destabilliser
la liaison chimique.
1- molécules diatomiques
Dans la méthode LCAO, l’orbitale moléculaire
Φ
sera définie comme combinaison
linéaire des orbitales atomiques
ψ
:
Dans le cas d’une molécule AB
Φ
= c
1
ψ
A
+ c
2
ψ
B
c
1
et c
2
sont des coefficients réels.
17
La probabilité de présence est :
dP =
⏐Φ
(x,y,z,t)
⏐
2
dV
La fonction d'onde
Φ
doit satisfaire une certaine condition de normalisation :
P =
∫
espace
⏐ Φ
⏐
2
dV = 1
* La combinaison de N orbitales atomiques condui
t à la formation de N orbitales moléculaires
* Deux orbitales atomiques ne pe
uvent se combiner que si :
- Leurs énergies sont voisines.
- Elles ont la même symétrie par
rapport à l'axe de recouvrement.
Diagramme énergétique
Exemples :
Li
2
, Be
2
, B
2
, O
2
, N
2
, Ne
2
, F
2
Ordre de liaison :
Il est défini par l’expression :
l
L
= ½ (n - n*)
n : nombre d’électrons des orbitales liantes
n* : nombre d’électrons des orbitales antiliantes
l
L
: nombre de liaisons entre les atomes.
2- Molécules polyatomiques :
a- Hybridation
La théorie d’hybridation perme
t d’expliquer la géométrie de
certaines molécules. Elle
donne aussi les valeurs des angles
que font entre elles les di
rections des liaisons dans une
molécule polyatomique.
Il existe trois types d’hybridation : sp
3
, sp
2
et sp.
Hybridation sp
3
: tétragonale
Dans la molécule CH
4
, Les quatre liaisons C-
H sont identiques. Elles f
ont un angle de 109°28’.
Une structure tétraédrique réguliè
re a été adoptée avec le carbone au centre de polyèdre et les
atomes d’hydrogène aux sommets.
Pour expliquer cette
forme tétraédrique de CH
4
on procède par étape.
•
1
ère
étape
Configuration du carbone à l’état fondamental : 1s
2
2 s
2
2 p
2
On ne considère que les électrons de valence.
Le carbone possède 2 électrons célibataires.
Il ne peut former que deux liaisons.
2
ème
étape
Configuration électronique du carbone à l’état excité : 1s
2
2 s
1
2 p
3
Selon l’état excité :
Le carbone présente quatre électrons
célibataires. On peut donc ex
pliquer quatre liaisons dont
seulement trois sont identiques, ce qui
est en désaccord avec l’expérience.
18
* 3
ème
étape
Orbitales hybrides sp
3
On considère que le carbone
dans son état réactionnel possède
quatre orbitales hybrides
équivalentes qui sont obtenues en mélangeant les
orbitales atomiques de base 2s, 2px, 2py et
2pz.
Hybridation sp
2
: trigonale
Exemple : BF3
C’est une molécule plane. Les tr
ois liaisons B-F sont identiques
sur le même plan et font un
angle de 120° entre elles.
On procède comme précédemment.
On considère de la même manière que le bore
dans son état réactionnel
possède trois orbitales
équivalentes contenants chacune un électron.
Ces orbitales sont dites hybrides sp
2
. Elles sont
obtenues en combinant 2 orbitales
p avec une orbitale s. Le
bore dans son état garde une
orbitale p
z
pure.
Hybridation sp
: digonale ou linéaire
Exemple : l’acétylène C
2
H
2
La molécule est linéaire. Les de
ux liaisons C-H sont
identiques et font
un angle de 180° entre
elles.
Les orbitales hybrides sp sont obtenues par co
mbinaison linéaire d’une
orbitale s avec une
orbitales p (p
x
par exemple).
b-
Prévision de la géométrie des molécules : théorie de Gillespie
(Théorie de la répulsion des paires élec
troniques des couches de valence : VSEPR
L’objectif de la VSEPR est de prévoir la géométrie des molécules de type AX
n
à partir du
nombre de doublets électroniques mis en
jeu autour de l’atome central A .
n : nombre d’atomes
X autour de A (2
≤
n
≤
6).
Les doublets électroniques s’arrangent pour que les
répulsions soient les plus faibles.
Selon le nombre de doublets libres et le nombre
d’atomes X, les formes géométriques possibles
qui correspondent à la répulsion minimale
sont données dans le tableau ci-dessous.
Remarque
: Ces différents arrangements correspondent
tous à des liaisons simples entre
l’atome central A et les atomes X.
Lorsqu’il existe une liaison multiple, la théorie VSEPR la considère comme une liaison simple.
Exemple :
dans la molécule H-CN on ne considère qu
e deux liaisons et pas de doublets libres
(molécule type AX
2
). La géométrie et linéaire.
H
2
CO : type AX
3
donc géométrie triangulaire
α
<
120° à cause l’encombrement électroni
que dans la direction CO.
* le même phénomène est rencontré dans le cas
où l’atome central présente des doublets non
liants.
Exemple
: Dans les molécules CH
4
, NH
3
et H
2
O, la géométrie de base est un tétraèdre, mais
les angles de liaison (HÂH) sont respecti
vement égales à 109°28’, 107° et 105°.
Environ 910 000 résultats (0,29 secondes)
Résultats de recherche
-
[PDF]
www.juggling.ch/gisin/coursphys3eme/1c_electrostat.pdf
L'électrostatique (l'étude des charges électriques au repos) .... se meuvent rapidement en direction de la charge positive, tout comme ils s'éloignent très vite d' ...
-
[PDF]
exvacuo.free.fr/.../Phys%2039-43%20Electromagnétisme%20(régimes%...
Dans toute la suite, nous qualifierons de régime électrostatique une situation à courant j nulle, en régime permanent, caractérisée par l'absence de tout champ ...
-
[PDF]
www.fresnel.fr/perso/stout/electromag/Rappel_elec.pdf
afin de ramener l'électrostatique `a une seule équation ... compliqués, le moment dipolaire électrostatique est donné par : .... tout l'espace εr ∥. ∥. ∥. −→.
-
[PDF]
www.klubprepa.fr/Site/Document/ChargementDocument.aspx?...4174
Page 1. Christian MAIRE. EduKlub S.A.. Tous droits de l'auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres ...
-
fr.wikipedia.org/wiki/Électrostatique
Il existe une expérience simple, que tout le monde peut faire, permettant de percevoir une force électrostatique : il suffit de frotter une règle en plastique avec un ...
-
f5zv.pagesperso-orange.fr/RADIO/RM/RM23/RM23B/RM23B06.html
L'électrostatique. ... Loi fondamentale de l'électrostatique ... est celui des "cheveux électriques" que tout un chacun a déjà observé en se coiffant par temps sec.
-
[PDF]
hal.archives-ouvertes.fr/docs/00/.../ajp-jphysrad_1934_5_6_241_0.pdf
de A Grumbach - 1934
Cependant on se borne en électrostatique à vérifier les applications de l'énoncé sans ... comme l'expérience nous apprend que tout courant . électrique est ...
-
[PDF]
ipag.obs.ujf-grenoble.fr/~ferreirj/enseignement/EChapitreII.pdf
une simple conséquence de la décroissance du champ électrostatique en 1 2 .... dans tout l'espace et qui permet de reconstruire le champ électrostatique E.
-
[PDF]
dossier.univ-st-etienne.fr/marinemm/www/Elect_Chap1.pdf
Tout le monde a déjà vécu l'expérience désagréable d'une "décharge ..... or tous о о. ⇒. (dans ce cas dl>0). Cours Electrostatique – Charge électrique Potentiel ...
-
[PDF]
cours.medecine.2007.free.fr/Site.../%20resume%20electrostatique.pdf
Généralités. Électrostatique: distribution des charges figées (= au repos)! ... Ce sont
Utilisateur root
Le terme root (uniquement en minuscule, litt. « racine ») est sur les systèmes d'exploitation de type Unix le nom conventionnel de l'utilisateur qui possède toutes les permissions sur le système, aussi bien en mode mono qu'en mode multi-utilisateur.
Son user identifier (user id ou uid) est 0, qui est traité particulièrement par le noyau dans les appels système.
Utilité
L'utilisateur root est également connu sous le nom de substitute-user. Généralement, c'est le compte administrateur. L'utilisateur root a la possibilité de faire tout ce qu'un utilisateur normal ne pourrait pas faire, comme changer l'appartenance de tous les fichiers. La séparation entre les droits de l'administrateur et les droits d'un utilisateur normal permet d'avoir un système d'exploitation plus résistant aux virus, ainsi qu'aux autres programmes malveillants. De plus cela donne davantage de tranquillité à l'administrateur, car les utilisateurs ne peuvent quasiment rien casser dans le système, que ce soit par mégarde ou dans l'optique de s'octroyer plus de droits.
Précautions
De manière générale, l'utilisation du compte root comme compte utilisateur classique comporte des risques et nécessite une grande vigilance, car de simples erreurs de typographie peuvent causer des dégâts irréversibles. Les différents systèmes d'exploitation recommandent de n’effectuer une action en tant qu'utilisateur root que lorsque cela est nécessaire. Pour cela l'action est de passer par l'intermédiaire d'un compte d'utilisateur normal et de passer par la commande su. Pour une utilisation directe, il existe aussi la commande sudo suivie de la ligne de commande à effectuer.
Sur certains systèmes tels que Mac OS X, le mot de passe de root n'est ni demandé, ni communiqué à l'utilisateur lors de l'installation, ce qui oblige celui-ci à utiliser sudo pour administrer son système, A moins que l'utilisateur change lui même le mot de passe root en utilisant su a travers sudo (Exemple : root@wikipedia#:sudo su) et en utilisant "passwd" pour changer le mot de passe une fois root.
Le lancement d'applications courantes (navigateur, traitement de texte, bavardage clavier, etc.) est fortement déconseillé en mode super-utilisateur, tout comme celui de l'interface graphique : cela crée différentes possibilités de compromission du système par divers services malveillants (virus informatique, cheval de Troie…).
|
|



.gif/220px-Lissajous_figures_on_oscilloscope_(90_degrees_phase_shift).gif)



































